硫酸銀
無色結晶或白色結晶性粉末。化學式Ag2SO4。遇光逐漸變黑色。在1085℃分解。相對分子質量311.80。密度5.45克/厘米3。熔點652℃,于1085℃分解。微溶于水。溶于氨水、硝酸、硫酸,不溶于乙醇。可用來作化學試劑。
物化性質
性狀:溶于硝酸,氨水和濃硫酸,慢慢地溶于125份水和71份沸水,不溶于乙醇。在純水中為微溶,并且受溶液環境PH的減小而增大,當氫離子濃度足夠大時可以有明顯的溶解現象。
1.遵照規格使用和儲存則不會分解。
2.微溶于水,不溶于乙醇,易溶于氨水和濃硫酸中。遇光分解變暗。
熔點652℃。有刺激性。
密度 5.45
沸點 1085 oC
水溶性 7.4 G/L (20 oC)
溶解性 溶于硝酸、氨水和濃硫酸,慢慢地溶于125份水和71份沸水,不溶于乙醇。
貯存 密封干燥避光保存。SCRC 200369
溶于硝酸的原因:
這里超出中學知識范圍,具體跟硫酸電離有關。雖然中學的時候我們經常強調硫酸是強酸,在水中完全電離,然而這個說法不準確。硫酸的第一步電離的的確是完全的(嚴格來說由于正負離子物理的相互作用,強電解質仍然不會完全電離,但理論上是完全電離的),但是第二步硫酸氫根的電離不完全,硫酸氫根只是一個比較強的弱酸(也可認為是中強酸),酸性和磷酸差不多:
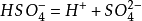
(可逆)
也就是說硫酸根實際上可以與氫離子結合,生成硫酸氫根這種弱電解質。復分解反應的實質是生成弱電解質,所以硫酸銀會與硝酸發生某程度上的反應。
方程式為:Ag2SO4 + HNO3 = AgHSO4 + AgNO3 (可逆)
這樣可使硫酸銀這種微溶物質在有硝酸的情況下溶解度大大增加。這也就是為了排除硫酸銀的可能要加硝酸酸化的原因,中學的參考資料只是這么說,但是并沒有給出任何原因,這樣做難免會引起懷疑其真實性,故此說明。中學的三大強酸只使用硝酸排除。
另外硫酸銀溶于氨水是因為形成了更穩定的配合物(銀氨離子),銀鹽一般都會反應。
產品有100g/瓶,1000g/瓶,5kg/袋 的包裝。




